编者按
由中国抗癌协会主办,河南省肿瘤医院(郑州大学附属肿瘤医院)、河南省癌症基金会承办,国际抗癌联盟(UICC)、中国工程院医药卫生学部、中国整合医学发展战略研究院共同协办的2021中国肿瘤学大会(CCO)将于2021年11月18-21日在郑州市隆重召开。
日前,2021 CCO主旨报告专家尘埃落定,7位大咖将于2021中国肿瘤学大会为全国肿瘤医务工作者奉献一场精彩绝伦的学术盛宴。本期【2021 CCO】专题抢先看主旨报告详情内容。
主旨报告
主旨报告专家
郝继辉 教授
天津市肿瘤医院党委副书记、院长、主任医师
国家肿瘤临床医学研究中心执行副主任
中国抗癌协会科技奖一等奖和天津市科技进步一等奖等奖项4项
中国抗癌协会常务理事
中国抗癌协会肿瘤精准治疗专业委员会候任主委
题目:胰腺癌肝转移——困境逢出路
郝继辉教授
天津市肿瘤医院
前言背景
胰腺癌是公认的恶性度最高的肿瘤,5年生存率不足10%。胰腺癌诊治困难主要在于其起病隐匿、转移迅速。肝脏是胰腺癌最易发的转移器官,与其他肿瘤不同,胰腺癌肝转移表现出以下三大特征:小肿瘤并发大转移,根治术后短期内仍出现肝转移,肝转移确诊后平均生存期极短,仅3-6个月。
胰腺癌肝转移的发生发展机制及干预策略是学界公认的难题。郝继辉教授作为国内外知名的胰腺肿瘤专家,带领团队在该领域深耕10余年,探索肿瘤微环境在胰腺癌肝脏转移中发挥的作用,阐明了纤维化、乏氧、免疫抑制以及异常血管新生等多个肿瘤微环境(TME)特征参与促进胰腺癌肝转移的作用机制,取得系列创新性成果:创新性地揭示了IL-35、ESE3、FOXP3等驱动胰腺癌发生肝转移的蛋白分子,多维度解析了胰腺肿瘤微环境特征,并确定了多个可用于临床检测和治疗的靶点,创新性地开展临床转化研究,相关肿瘤微环境高亲和纳米化药物的设计思路和载体药物被国内外同行多次引用和借鉴,为新的治疗策略和药物开发提供了临床前依据。团队的创新性研究为胰腺癌肝转移的研究与诊治开辟了新的路径,具有良好的临床应用前景,产生了良好的社会效益并提升我国胰腺肿瘤学科国际学术影响力。

科研进展
TME相关的转录因子EHF和FOXP3参与胰腺癌浸润免疫细胞的重塑过程
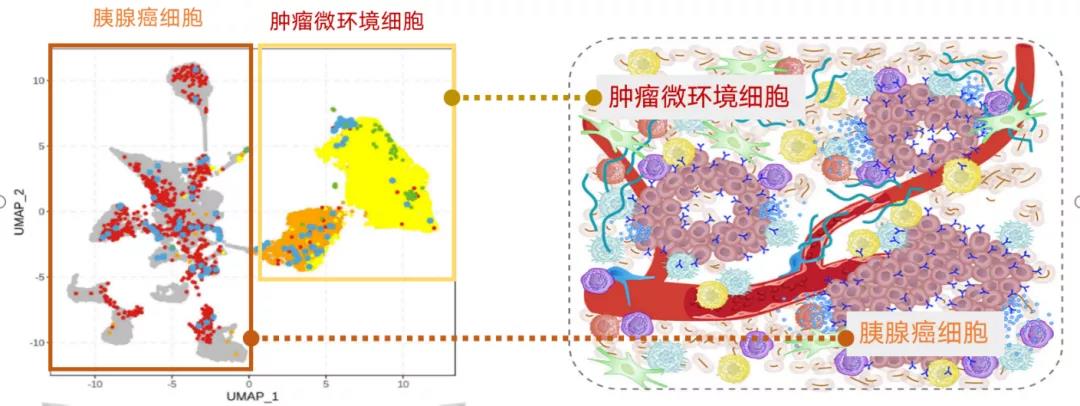
免疫治疗为肿瘤治疗打开一扇新的大门,全球范围内,针对不同的免疫微环境特点以及不同免疫抑制细胞的亚群也有相应的药物在开展临床试验(如针对巨噬细胞目前开展的有CD11b、CSF1R抗体以及YI3Kγ阻滞剂,针对MDSC为ly6G抗体以及CXCR2 inhibitor,针对Treg有TGFβ、CD25、CTLA4抗体,针对Breg有IL10、IL35中和抗体,针对耗竭性T细胞有PD1、PDL1、CTLA4及IL27抗体,针对DC分化障碍有CD40、Flt3L抗体,针对T细胞阻隔有TCR、CART治疗)。然而,针对胰腺癌的免疫治疗研究却陷入窘境,究其原因是缺乏对胰腺癌免疫微环境特征全面和准确的阐述。现有研究根据免疫微环境对胰腺癌进行初步分型(包括免疫沙漠型、免疫排斥型、炎性表型),郝继辉教授团队在此基础上,创新性阐明肿瘤TME相关的转录因子EHF和FOXP3参与胰腺癌浸润免疫细胞的重塑过程,并将肿瘤干细胞与免疫微环境重塑有机结合在一起,为胰腺癌的免疫治疗提供全新的视角。
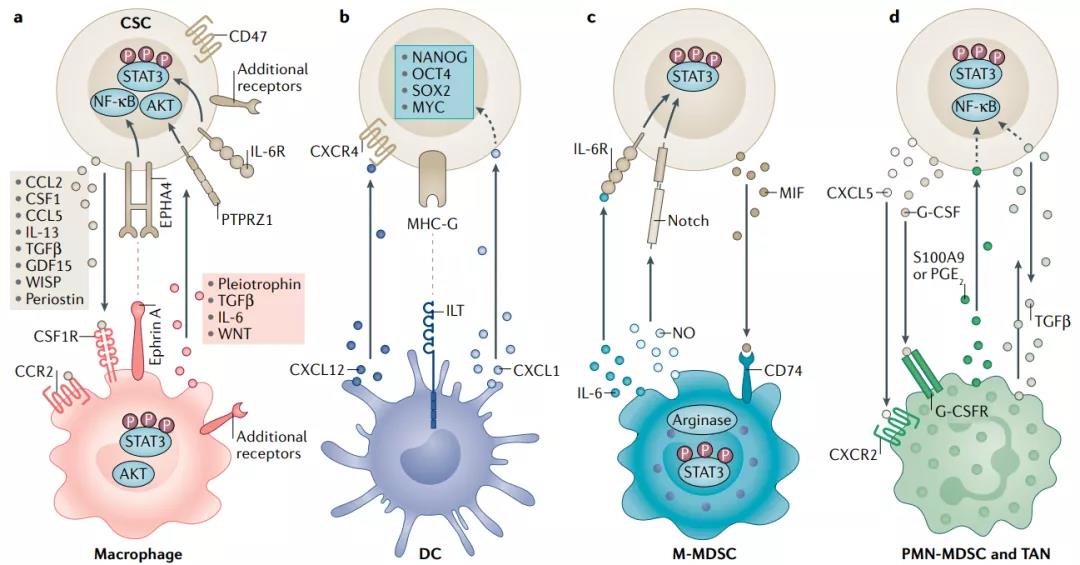
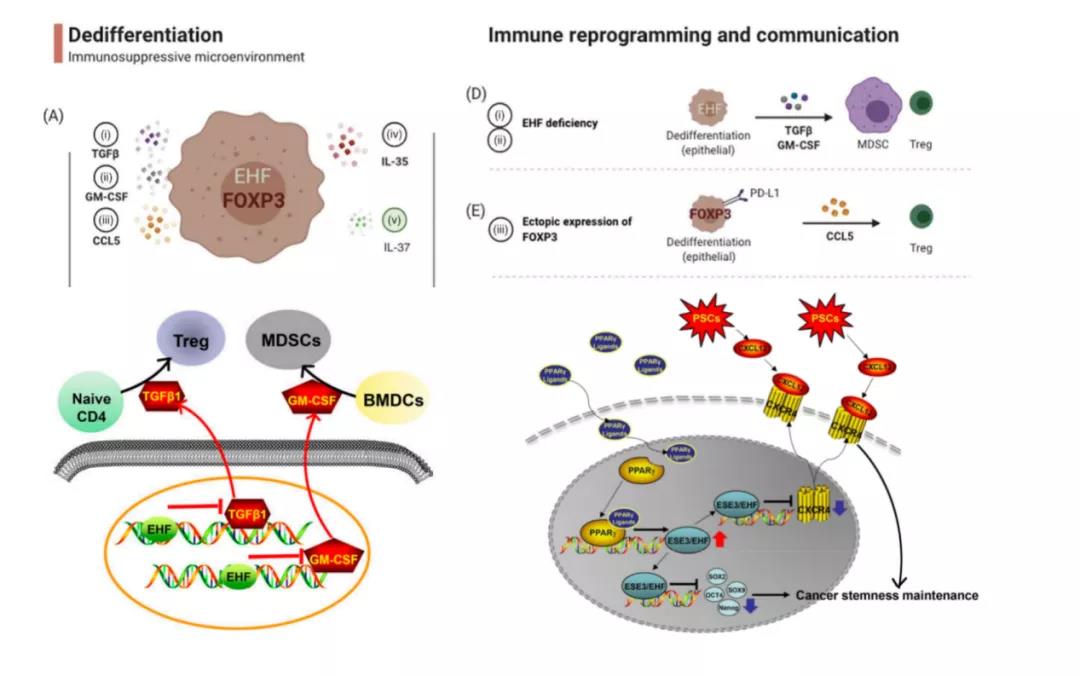
我们研究发现转录因子EHF缺失导致胰腺癌分泌更多的TGFβ以及GM-CSF,进而诱导Treg细胞、MDSC的聚集以及CD8+T细胞凋亡及耗竭。转录因子FOXP3在胰腺癌细胞的异位特异性表达并通过上调CCL5以及PD-L1的表达促进Treg细胞向肿瘤微环境的趋化浸润,参与增强免疫抑制,转录因子EHF和FOXP3可以作为胰腺癌抑制性免疫微环境重塑的分子标签。EHF表达减低同时促进CXCR4表达上调,诱导肿瘤干性表型并加重免疫抑制,提示肿瘤干细胞与免疫微环境之间存在交互作用。基于此研究的CXCR4阻断剂BL-8040的二期临床试验正在开展,即COMBAT的临床试验(NCT02826486)旨在评估靶向肿瘤细胞干性协同免疫治疗在胰腺癌中发挥抗肿瘤作用。
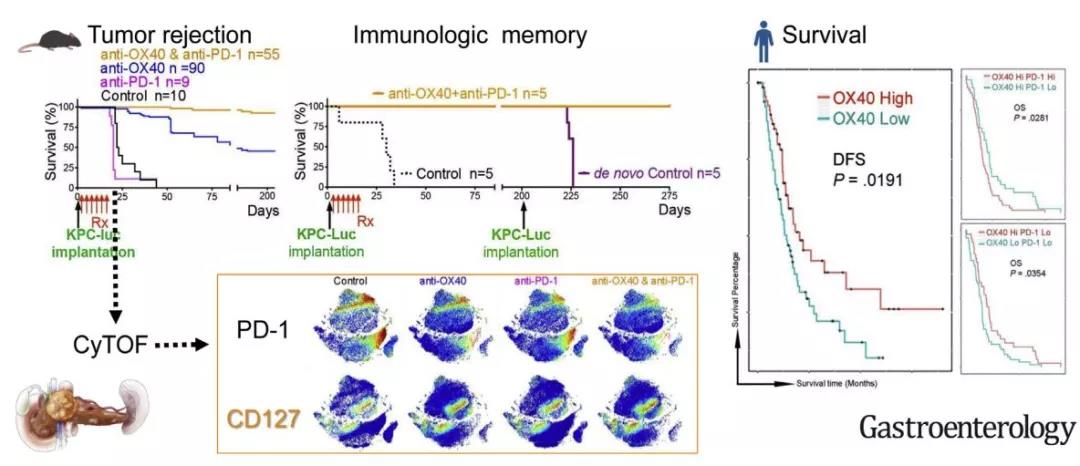
与此同时,我们在另一项研究联合应用OX40激动剂和PD-1阻断剂诱导原位肿瘤缩小及转移灶消失。应用质谱流式检测肿瘤浸润T淋巴细胞,发现其免疫治疗效果归因于激活OX40和阻断PD-1联合激发了T淋巴细胞免疫记忆的形成和T细胞耗竭的减少。结合临床应用胰腺癌患者的TCGA数据印证了OX40信号的激活和PD-1通路的下调对患者生存获益。
IL-35、BICC1基因调节血管间质以促进肿瘤血管生成
肿瘤新生血管为原发肿瘤提供养料,促进肿瘤生长,同时新生血管又是导致肿瘤细胞进入血循环并发生转移的主要路径。但其生成新生血管多是不成熟有缺陷的,血管内皮缺乏基底膜且完整性不良,导致肿瘤细胞易进入血循环形成CTC。高速运动的CTC随血流在靶器官内选择性黏附于血管内皮上,结合粘附分子以出血管过程侵袭靶器官。我们研究发现多条VEGF非依赖性血管生成途径被激活,明确了传统抗血管生成治疗在胰腺癌中失败的原因。通过单细胞测序、生物信息学分析等手段已筛查鉴定出驱动胰腺癌特征性血管生成的关键基因。IL-35通过招募单核细胞,促使其分泌血管生成因子CXCL1及CXCL8,激活胰腺癌血管生成,抗IL35抗体抑制胰腺癌血管生成并增强吉西他滨的化疗效果。BICC1通过调控炎性因子LCN2,在胰腺癌的VEGF非依赖性途径中引起贝伐单抗耐药。BICC1低表达的胰腺癌中,贝伐单抗具有一定的抑瘤效果;BICC1高表达的胰腺癌组织,阻断BICC1信号通路可以有效地抑制肿瘤血管生成。IL35过表达后,通过上调血管内皮粘附分子ICAM1表达,增强胰腺癌细胞的血管黏附过程及跨内皮迁移过程,促使胰腺癌肝转移。基于我们前期的研究,哈佛大学医学院Moses教授团队进行了转化研究,他们也发现胰腺癌组织内ICAM1表达也明显地上调,采用ICAM1抗体阻断IL35/ICAM1信号通路后可以明显的抑制胰腺癌肝转移的发生。

肿瘤相关成纤维细胞(CAF)在胰腺癌肝转移重要作用
胰腺癌的微环境由大量的间质成分组成,包括多种间质细胞和细胞外基质成分,它们在胰腺癌肝转移的各个阶段都发挥着重要作用,既能促进“种子”的散播,又能帮助形成合适的“土壤”,促进“种子”在靶器官的定植和生长。因此在靶向“种子”的各种治疗均不理想的情况下,郝继辉教授认为靶向微环境中的间质可能是治疗胰腺癌转移的一个重要突破口。
胰腺癌间质中的肿瘤相关成纤维细胞(CAF)在TME中含量多且分泌旺盛,在胰腺癌肝转移过程中,其通过旁分泌TGF-β等细胞因子促进肿瘤细胞发生EMT并抑制肿瘤免疫;通过分泌MMP9、VEGF等细胞因子促进肿瘤进展以及血管生成,调节TME中间质压力,纤维化影响药物递送并分泌炎性因子诱发肿瘤耐药。本团队发现在胰腺癌微环境中CAF通过激活内质网应激相关通路PERK-eIF2a-ERK1/2信号通路发生转分化,获得内皮细胞表型及功能,直接参与肿瘤血管生成,促进胰腺癌肝转移。我们首次鉴定出一类表达CD144的CAF(其表达率大约为29%),功能实验证实该类CD144+CAF与肿瘤转移与白蛋白紫杉醇耐药密切相关。
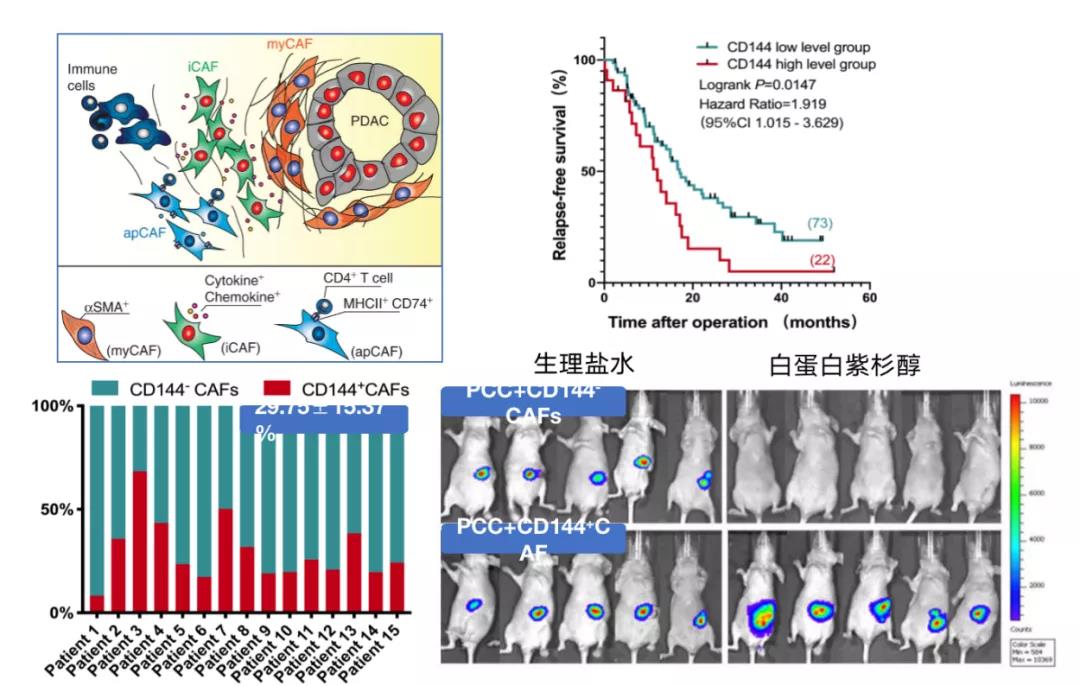
基于此我们提出靶向胰腺癌微环境中CAF的转化治疗策略。目前精准靶向CAF的治疗策略大致可分为五类:(1)通过如α-SMA等标志物靶向清除CAF;(2)通过ATRA等药物使得激活的CAF正常化(normalize)为静息态;(3)通过靶向Shh等信号通路从而靶向CAF;(4)通过透明质酸酶PEGPH20等药物降低胰腺癌间质压力,从而提高药物递送;(5)通过纳米技术包被药物进入CAF,从而提高药物递送效率。
精准化治疗策略
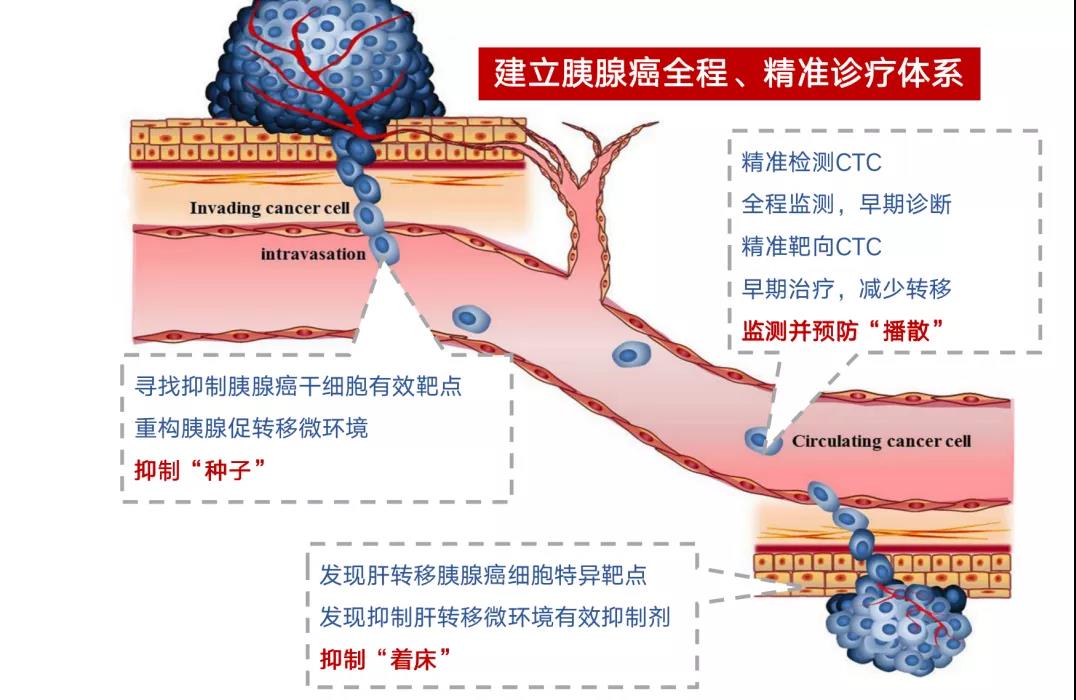
靶向胰腺癌肝转移的“三二一”治疗策略
基于前面一系列围绕胰腺癌肝转移的研究成果,本研究团队首次对胰腺癌肝转移生物学行为进行全景化描述,也初步建立了靶向胰腺癌肝转移的“三二一”治疗策略:“三个重塑”即基质重塑、血管重塑和免疫重塑;“两个抑制”即抑制肿瘤干性、抑制肿瘤着床;“一个监测”即监测循环CTC及ctDNA,以建立胰腺癌肝转移的全程、精准诊疗体系。
胰腺癌微环境特征综合分析
团队利用临床平台优势,基于20例胰腺癌肝转移患者配对的原发灶和转移灶的单细胞测序和对胰腺癌微环境细胞基因特征分析将胰腺癌分为星形细胞优势型、免疫抑制豁免型、血管新生优势型和其他型,并绘制了每个胰腺癌患者的间质指纹,为后续的临床试验设计和治疗方案选择提供重要依据。通过基础转化性研究,我们根据ESE3、IL35及CD144三个marker鉴别此三种具有间质指纹的不同类型转移性胰腺癌,在体外实验验证敏感的化疗方案基础上,分别针对不同的marker联合应用小分子抑制剂及靶向药物,设计了不同组别的临床试验,以期通过这种贯彻精准而又不失个体化特点的临床试验为更多的转移性胰腺癌患者寻找靶向间质的新型治疗方案。